16.10.09
Нобелевской премией по химии в этом году вновь, как и в прошлом, наградят биологов: их достижения связаны прежде всего с использованием метода рентгеноструктурного анализа, широко применяемого в биохимии и выведенного при активном участии лауреатов на новый уровень. Премию «за исследования строения и работы рибосом» разделят Ада Йонат, Венки Рамакришнан и Томас Стайц. Рибосомы представляют собой «белковые фабрики» клетки: именно их работа обеспечивает синтез белка из аминокислот, лежащий в основе жизнедеятельности всего живого. Отмеченное премией достижение сыграло немалую роль в развитии науки; у него есть и непосредственные практические приложения — в частности, разрабатываются и совершенствуются антибиотики, убивающие болезнетворных бактерий за счет выключения их рибосом.

Нобелевскую премию по химии в этом году разделят трое биохимиков: Ада Йонат (Ada E. Yonath) из израильского Института Вейцмана (Weizmann Institute of Science), Венкатраман (Венки) Рамакришнан (Venkatraman “Venki” Ramakrishnan), гражданин США, работающий в настоящее время в кембриджской Лаборатории молекулярной биологии Медицинского исследовательского совета (Medical Research Council Laboratory of Molecular Biology), и Томас Стайц (Thomas A. Steitz) из Йельского университета (Yale University). Премия присуждена им «за исследования строения и работы рибосом» («for studies of the structure and function of the ribosome»). Рибосомы, в изучении структуры и механизма работы которых ключевую роль сыграли лауреаты этой премии, составляют неотъемлемый компонент всех живых клеток. С их помощью на матрице информационной РНК в клетках синтезируются все белки, в том числе ферменты, управляющие всеми происходящими в клетке химическими процессами.
Ада Йонат родилась в 1939 году в Иерусалиме в очень бедной семье евреев-иммигрантов. В 1962 году она получила степень бакалавра по химии, а в 1964 году — магистра по биохимии в Еврейском университете в Иерусалиме. Значительная часть ее дальнейшей научной карьеры была связана с Институтом Вейцмана в Реховоте, где в 1968 году она получила докторскую степень за рентгеноструктурные исследования. В 1969–70 годах она работала в США, в том числе в Массачусетском технологическом институте. С 1988 года она работает профессором на отделении структурной биологии Института Вейцмана, а с 1989 года возглавляет в этом институте исследовательский центр, изучающий комплексы биологических молекул. Параллельно с работой в Институте Вейцмана Ада Йонат читала лекции и руководила исследованиями в нескольких других научных учреждениях Израиля, Германии и США.- Венки Рамакришнан родился в 1952 году в городке Чидамбарам на юге Индии, в семье, принадлежавшей к касте брахманов. Его детство прошло в другом индийском городе, Барода (теперь называемом Вадодара), где он впоследствии учился в университете и в 1971 году получил степень бакалавра по физике, после чего уехал в США, где в 1976 году получил докторскую степень, также по физике, в Университете Огайо. После этого он решил оставить физику и заняться биологией. Два года он учился биологии в Калифорнийском университете в Сан-Диего, затем работал в Йельском университете (где и начались его исследования рибосом) и в нескольких других научных учреждениях США, а в 1999 году переехал в Англию, где возглавил исследовательскую группу в Лаборатории молекулярной биологии в Кембридже. С 2008 года является также сотрудником Тринити-колледжа Кембриджского университета.
- Томас Стайц родился в 1940 году в Милуоки (штат Висконсин). Он получил степень бакалавра по химии в Университете Лоуренса в Висконсине, а затем учился в Гарварде, где в 1966 году получил докторскую степень по биохимии и молекулярной биологии. С 1967-го по 1970 год он работал в Лаборатории молекулярной биологии Медицинского исследовательского совета в Кембридже, а с 1970 года работает в Йельском университете, где в настоящее время является профессором молекулярной биофизики и биохимии. Кроме Йеля, Стайц также сотрудник Медицинского института Говарда Хьюза (Howard Hughes Medical Institute). Жена Томаса Стайца, Джоан Стайц — тоже профессор молекулярной биофизики и биохимии в Йеле.
Хотя формулировка «за исследования строения и работы рибосом» довольно расплывчата, судя по всему, эту премию присудили за вполне конкретные достижения — первые модели структуры рибосом на атомарном уровне, полученные с помощью рентгеноструктурного анализа.
Рибосомы представляют собой белковые фабрики, работающие во всех живых клетках. Рибосомы прокариот меньше по размеру, чем рибосомы эукариотических клеток, но и те, и другие состоят из двух субъединиц, большой и малой, каждая из которых построена из нескольких молекул РНК (это так называемая рибосомальная РНК, или рРНК) и нескольких десятков различных белков. Механизм работы рибосом исследуется уже не один десяток лет, но многие детали этого механизма по-прежнему не удалось выяснить, а подробные модели строения рибосом были получены лишь на рубеже XX-го и XXI веков.
Методы рентгеноструктурного анализа позволяют судить о строении биологических макромолекул и их комплексов (в частности, эти методы помогли установить в 1953 году структуру ДНК). В основе рентгеноструктурного анализа лежит получение кристаллов макромолекул и просвечивание их рентгеновскими лучами. По характеру дифракции рентгеновских лучей, проходящих через эти кристаллы, можно судить о строении образующих кристаллы молекул. Однако к началу восьмидесятых годов XX века никому еще не удавалось получить пригодные для анализа кристаллы ни полных рибосом, ни их отдельных субъединиц.
Первые успешные попытки кристаллизовать рибосомы для исследования их строения с помощью рентгеновских лучей были предприняты в восьмидесятые годы Адой Йонат в Берлине и, независимо от нее, группой из Института белка в Пущино, в состав которой вошли Марат и Гульнара Юсуповы, впоследствии продолжившие исследования рибосом на Западе. Но серьезный прорыв в этом направлении был сделан лишь в начале девяностых, когда группа Ады Йонат продемонстрировала возможность получения кристаллов большой субъединицы прокариотической рибосомы, дающих дифракционную картину с разрешением, которое позволяет определять положение отдельных атомов (до 3 Å и меньше; при этом размер рибосомы составляет около 200 Å). Но первые правдоподобные модели структуры рибосом удалось получить только после того, как технологию кристаллизации и методику анализа рентгеноструктурных данных усовершенствовали в ходе совместных исследований группы Питера Мура (Peter Moore) и Томаса Стайца в Йельском университете. В 2000 году в журнале Science была опубликована совместная статья этих групп, в которой была впервые подробно (с атомарным разрешением) описана структура большой субъединицы бактериальной рибосомы.
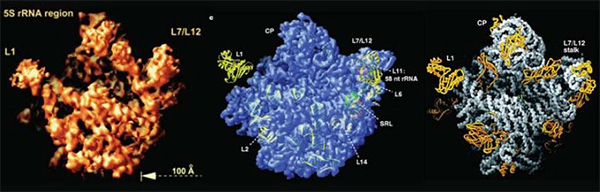
Тем временем группа Венки Рамакришнана, работавшая в Лаборатории молекулярной биологии в Кембридже, получила столь же подробную модель малой субъединицы рибосомы другого вида бактерий, и в том же году статья об этом была опубликована в Nature. Почти одновременно вышла статья Ады Йонат и ее сотрудников, добившихся с малой субъединицей бактериальной рибосомы почти такого же результата, хотя и допустивших, как впоследствии выяснилось, ряд ошибок в интерпретации ее структуры.
 Модель структуры целой рибосомы (то есть комплекса большой и малой субъединиц и молекул транспортной РНК, или тРНК, доставляющих аминокислоты к рибосоме) с менее детальным разрешением (7,8 Å), была впервые получена в 1999 году в лаборатории Гарри Ноллера (Harry F. Noller) из Калифорнийского университета в Санта-Крус при участии Марата и Гульнары Юсуповых, в то время уже работавших у Ноллера. За публикацией 1999 года последовала еще одна, в 2001 году, в которой структура целой рибосомы была описана с разрешением 5,5 Å, то есть близким к атомарному. В дальнейшем нескольким лабораториям, в том числе и лаборатории Ноллера, удалось получить модели структуры целой рибосомы и с атомарным разрешением. Первую такую модель (с разрешением 3,5 Å) представила группа, которой руководил Джейми Кейт (Jamie H.D. Cate) из Калифорнийского университета в Беркли.
Модель структуры целой рибосомы (то есть комплекса большой и малой субъединиц и молекул транспортной РНК, или тРНК, доставляющих аминокислоты к рибосоме) с менее детальным разрешением (7,8 Å), была впервые получена в 1999 году в лаборатории Гарри Ноллера (Harry F. Noller) из Калифорнийского университета в Санта-Крус при участии Марата и Гульнары Юсуповых, в то время уже работавших у Ноллера. За публикацией 1999 года последовала еще одна, в 2001 году, в которой структура целой рибосомы была описана с разрешением 5,5 Å, то есть близким к атомарному. В дальнейшем нескольким лабораториям, в том числе и лаборатории Ноллера, удалось получить модели структуры целой рибосомы и с атомарным разрешением. Первую такую модель (с разрешением 3,5 Å) представила группа, которой руководил Джейми Кейт (Jamie H.D. Cate) из Калифорнийского университета в Беркли.
Около двух третей массы рибосомы составляет РНК, а около трети — белки. Исследования строения и работы рибосом показали, что функциональную нагрузку в рибосомах несет, прежде всего, РНК. Таким образом, рибосомы — это, по сути, гигантские рибозимы. Это открытие говорит в пользу гипотезы, согласно которой на первых этапах существования жизни она представляла собой «мир РНК»: молекулы РНК обеспечивали и хранение наследственной информации, и управление химическими процессами, необходимыми для считывания и воспроизведения этой информации; впоследствии эти функции в ходе эволюции были переданы соответственно ДНК и белкам.
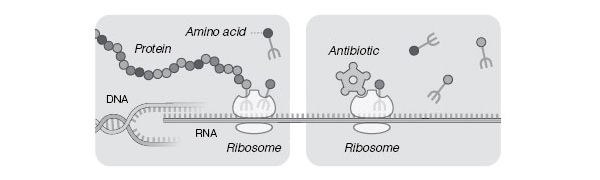
Представления о структуре рибосом находят и непосредственное практическое применение. Многие антибиотики, используемые для лечения инфекционных заболеваний, действуют за счет подавления работы бактериальных рибосом. В лабораториях Йонат, Рамакришнана и Стайца были получены данные о механизме действия ряда таких антибиотиков. Эти данные уже сегодня используются для разработки новых и совершенствования существующих антибиотиков. Задача эта весьма актуальна, поскольку болезнетворные бактерии непрерывно эволюционируют, вырабатывая устойчивость к используемым в медицинской практике средствам, и фармацевтике нельзя отставать от бактерий в этой непрерывной «гонке вооружений».
Каждая Нобелевская премия может быть разделена не более чем на троих, и выбор этих троих из числа достойных претендентов бывает небесспорным и почти всегда оставляет в тени ученых, чей вклад в отмеченное премией открытие тоже заслуживает признания. Так случилось и в этот раз. К тем выдающимся исследователям строения рибосом, кто не попадет в число награжденных этой премией, относятся Питер Мур, Джейми Кейт и Марат Юсупов. Но особенно несправедливо отсутствие в числе лауреатов Гарри Ноллера, который первым показал ключевую роль РНК в работе рибосом, первым прочитал последовательность нуклеотидов рибосомальной РНК и выяснил ее вторичную структуру (то есть как она свернута), закартировал места связывания большинства лигандов рибосомы, первым установил структуру целой рибосомы в комплексе с молекулами тРНК — и при этом оказался четвертым лишним.
Хотя сделанный Нобелевским комитетом выбор трех лауреатов и можно считать спорным, само научное достижение, за которое их наградят, вполне достойно Нобелевской премии по химии. В ходе исследований строения рибосом были усовершенствованы методы рентгеноструктурного анализа, что позволило описывать с атомарным разрешением взаимодействие рибосомы с белками, управляющими ее работой, и с молекулами тРНК, а также изменения, происходящие в структуре рибосомы в процессе синтеза белка. На сегодняшний день рибосомы — самые большие несимметричные макромолекулярные комплексы с установленной структурой (строение вирусов изучать легче в связи с их симметричностью). Можно ожидать, что в дальнейшем рентгеноструктурный анализ будет успешно применен и для исследования строения и работы других крупных макромолекулярных комплексов, например сплайсосом, вырезающих из предшественников информационной РНК некодирующие последовательности (интроны).
Источник: Название


 Модель структуры целой рибосомы (то есть комплекса большой и малой субъединиц и молекул транспортной РНК, или тРНК, доставляющих аминокислоты к рибосоме) с менее детальным разрешением (7,8 Å), была впервые получена в 1999 году в лаборатории Гарри Ноллера (Harry F. Noller) из Калифорнийского университета в Санта-Крус при участии Марата и Гульнары Юсуповых, в то время уже работавших у Ноллера. За публикацией 1999 года последовала еще одна, в 2001 году, в которой структура целой рибосомы была описана с разрешением 5,5 Å, то есть близким к атомарному. В дальнейшем нескольким лабораториям, в том числе и лаборатории Ноллера, удалось получить модели структуры целой рибосомы и с атомарным разрешением. Первую такую модель (с разрешением 3,5 Å) представила группа, которой руководил Джейми Кейт (Jamie H.D. Cate) из Калифорнийского университета в Беркли.
Модель структуры целой рибосомы (то есть комплекса большой и малой субъединиц и молекул транспортной РНК, или тРНК, доставляющих аминокислоты к рибосоме) с менее детальным разрешением (7,8 Å), была впервые получена в 1999 году в лаборатории Гарри Ноллера (Harry F. Noller) из Калифорнийского университета в Санта-Крус при участии Марата и Гульнары Юсуповых, в то время уже работавших у Ноллера. За публикацией 1999 года последовала еще одна, в 2001 году, в которой структура целой рибосомы была описана с разрешением 5,5 Å, то есть близким к атомарному. В дальнейшем нескольким лабораториям, в том числе и лаборатории Ноллера, удалось получить модели структуры целой рибосомы и с атомарным разрешением. Первую такую модель (с разрешением 3,5 Å) представила группа, которой руководил Джейми Кейт (Jamie H.D. Cate) из Калифорнийского университета в Беркли.